近日,君实生物披露2020年业绩快报,营业收入同比增长达到105.77%。值得关注的是,在发布业绩快报前不久,君实生物在信息披露中公告了多款在研产品的最新消息。那么在这些公告背后,蕴含着什么信息呢?
特瑞普利单抗:新添适应症,首发提交美国BLA
在国产PD-1市场竞争越来越激烈之下,如何能在差异化竞争中脱颖而出成为诸多药企需要关注的问题。
近期,君实生物其核心产品特瑞普利单抗近期拟再添新适应症鼻咽癌,并且率先向FDA提交BLA,有望在适应症治疗中占领先机。
2月19-20日,君实生物公告特瑞普利单抗联合化疗用于晚期一线未接受过系统性治疗的复发转移性鼻咽癌的新适应症上市申请获得国家药品监督管理局受理、用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗的新适应症上市申请获得附条件批准。
鼻咽癌是一种发生于鼻咽部黏膜上皮的恶性肿瘤,是常见的头颈部恶性肿瘤之一。据世界卫生组织统计,2020年鼻咽癌在全球范围内确诊的新发病例数已达到13.3万,近半数发生在中国。鼻咽癌具备很强的地域集中性,主要发生于我国南方五省,即广东、广西、湖南、福建和江西,占当地头颈部恶性肿瘤的首位。
从临床数据上来看,基于全球范围内规模最大的免疫检查点抑制剂联合化疗一线治疗复发或转移性鼻咽癌的Ⅲ期临床研究结果,特瑞普利单抗联合吉西他滨/顺铂一线治疗复发或转移性鼻咽癌患者,较吉西他滨/顺铂的标准一线治疗,可显著延长患者的无进展生存期,为存量患者提供新的选择。
在国内申报新适应症之外,君实生物也在向美国FDA积极提交新适应症的申请。
3月3日,公司公告已向美国FDA提交特瑞普利单抗用于治疗复发或转移性鼻咽癌的生物制品许可申请(BLA)。结合此前特瑞普利单抗已经获得FDA突破性疗法认定来看,此次的BLA申请,意味着特瑞普利单抗用于治疗鼻咽癌可以向FDA滚动提交并获得滚动评审,成为首个向FDA提交BLA的国产PD-1产品。
总体来看,目前特瑞普利单抗已在中、美等多国开展了覆盖超过15个适应症的30多项临床研究,研究成果正在加速转化为适应症上市。对应适应症如在国内已获批的黑色素瘤、鼻咽癌,在途的晚期尿路上皮癌,未来的非小细胞肺癌等。在国外特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤领域获得美国食品药品监督管理局授予1项突破性疗法认定、1项快速通道认定和3项孤儿药资格认定。后续适应症逐渐获批将使特瑞普利单抗维持同类竞争力,扩大公司核心产品创收能力,为公司营收快速增长提供不可或缺的动力。
中和抗体:新冠双抗体疗法获紧急授权使用
另一个需要关注的就是君实生物有关于新冠在研药物JS016的商业化进展,有望为公司在2021年带来爆炸性增长。
根据君实生物2月10日公告,美国食品药品监督管理局批准了美国礼来制药公司在研抗体药物JS016(Etesevimab)1400mg及LY-CoV555(Bamlanivimab)700mg双抗体疗法的紧急使用授权,用于治疗重度新冠肺炎患者及有住院风险的12岁以上轻中度新冠肺炎患者。这是中国企业第一次获得此类授权,JS016也是第一个在美国获得大规模使用的中国自研生物药。
从临床数据上来看,双抗体疗法具有安全性佳、用药剂量低、用药时间短等优势。具体来看:
(1)安全性高。据2021年1月26日公布的BLAZE-1研究的Ⅲ期临床试验数据,使用JS016及LY-CoV555双抗体疗法能使新冠肺炎患者住院及死亡风险降低了70%。
(2)用药剂量低。相较于过去的试验数据,近期研究证明了JS016 1400mg联合LY-CoV555 700mg的治疗效果与JS016 2800mg联合LY-CoV555 2800mg相似。
(3)用药时间短。上述双抗体疗法用药方式接纳一线医疗人员建议,经美国食品药品监督管理局批准从原来的60分钟缩短至21分钟,极大的提高了治疗效率并减轻医疗系统的负担。在药物产能普遍不足但美国患者群体异常庞大的背景下,单个患者更低的用药剂量,更短的用药时间,让JS016正在面临极大的需求。
截至当前,LY-CoV555已在多国获得授权,JS016及LY-CoV555双抗体疗法已在美国和意大利获得授权。君实生物已将 JS016 大中华区以外权益授权礼来制药,获得 1000 万美元首付款,合计 2.45 亿美元里程碑付款,并能获得销售净额两位数比例的分成。
根据礼来制药的生产计划,2021年上半年将会生产100万剂JS016,其中10万剂即将准备就绪,一季度还将生产另外15万剂,二季度产能还将会按生产计划扩大。市场对JS016的极度需求有望在2021年为君实生物带来超20亿元的里程碑款及销售分成,即单一产品收入能超过去年全年营业收入。
多款在研药物:密集开启临床试验
除此之外,公司近期多款在研药物开启临床试验,为后续研发进行补充发力。具体来看:
1. JS006:获国家药监局批准进入临床,向FDA递交临床试验申请获受理
2021年1月,君实生物在研产品JS006注射液的临床试验申请获得国家药品监督管理局批准,同月君实生物向美国食品药品监督管理局递交临床试验申请获得受理。
JS006注射液是君实生物自主研发的特异抗性TIGIT单克隆抗体注射液,可特异性阻断TIGIT-PVR抑制通路,刺激杀伤性免疫细胞活化,分泌肿瘤杀伤性因子。多项临床前的试验结果显示抗TIGIT抗体与抗PD-1/PD-L1抗体可以发挥协同抗肿瘤作用。
关于JS006注射液的市场可行性分析,目前国内外并无同类靶点产品获批上市,而试验显示抗TIGIT抗体与抗PD-1/PD-L1抗体联合用药是一种有前途的抗癌策略,有望能增加患者对免疫治疗的反应。应当持续性关注药物临床试验数据,若在临床试验中证明药物具备理想的疗效,该药物有望打开一个全新的药物市场。
2. S110: 临床试验申请获国家药监局核准
在研的XPO1抑制剂JS110也传来了最新的消息,据君实生物2月17日公告,君实生物与微境生物共同投资的苏州君境生物提交的XPO1抑制剂JS110临床试验申请受到国家药物监督管理局的核准。
JS110是核输出蛋白的XPO1的小分子抑制剂,具备阻断XPO1蛋白功能,能够抑制包括p53在内多种抑癌蛋白出核,加强抑癌蛋白功能。在过往试验数据中,JS110能在体外抑制多种肿瘤细胞生长,诱发肿瘤细胞死亡。在肿瘤动物模型中,JS110单药或者联合用药可抑制多种血液和实体肿瘤的生长。作为其他治疗方式的补充,JS110的应用可以作为常规治疗方法无效时的替代选择,给晚期肿瘤病人带来全新的治疗手段。
3. JS111:临床试验申请获国家药监局核准
同样是苏州君境生物提交的JS111临床试验申请也受到国家药物监督管理局的核准。
JS111是一种有效抑制EGFR(表皮生长因子受体)非常见突变的靶向小分子抑制剂。现有的EGFR-TKI、化疗和免疫疗法对于携带EGFR exon 20插入等EGFR非常见突变的非小细胞肺癌患者临床获益有限,患者具有迫切的临床治疗需求。JS111保持了抑制T790M等EGFR常见变异的活性和对野生型EGFR的选择性,但同时克服了第三代EGFR抑制剂对exon 20插入等EGFR非常见突变的不敏感。JS111的开发有望给携带EGFR exon 20插入突变等EGFR非常见突变的肿瘤患者带来新的治疗方式。
4. JS201:获国家药监局临床试验申请受理
2月25日,君实生物收到国家药品监督管理局核准签发的《受理通知书》,PD-1/ TGF-β 双功能融合蛋白JS201注射液(项目代号“JS201”)的临床试验申请获得受理。
JS201 可有效阻断PD-1/PD-L1和TGF-β免疫抑制通路,改善肿瘤微环境中的免疫调节作用,从而促进人体免疫系统对于肿瘤细胞的杀伤作用,有效增强免疫应答,减少免疫逃逸及耐药性的发生 。目前,国内外尚无同类靶点产品获批上市。
2020业绩快报:研发引擎强劲,PD-1与中和抗体双轮驱动
最后来看一下公司此次公布的2020年度业绩快报。根据公告显示,公司实现营业收入15.95亿元,同比增长105.77%。其中,公司主要来自于特瑞普利单抗注射液销售收入的增长,以及新增技术许可收入所致。总体来看,公司依托PD-1与中和抗体双轮驱动,研发引擎强劲。
君实生物不断加强核心产品,国内首个获批上市的PD-1国产单抗药物,特瑞普利单抗注射液(商品名:拓益®)的市场推广力度,快速提升产品的医院覆盖率,将其纳入新版医保目录,特瑞普利单抗注射液的销售收入显著增长。
此外,随着公司研发成果转换能力的逐步显现,君实生物正积极开拓国际市场。如上月初君实生物发布公告称与Coherus (Coherus Biosciences,Inc.)签署了独占许可与商业化协议,公司的核心产品特瑞普利单抗注射液即将进军美国与加拿大市场,扩大旗下产品可销售范围。这意味着特瑞普利单抗或许是最快在美国上市的国产PD-1产品。
公告描述,在报告期内,公司持续加大研发投入,通过自主研发以及合作开发/权益引入(License-in)等形式不断丰富和拓展在研产品管线,快速推进现已进入临床阶段的项目进度并积极储备和推动临床前项目的开发。
截至公告披露日,公司产品管线已拥有30项在研药物,包括28个创新药物和2个生物类似药,覆盖包括恶性肿瘤、自身免疫系统疾病、慢性代谢类疾病、神经系统类疾病以及感染类疾病在内的五大治疗领域。
图表一:君实生物2020年度主要财务数据和指标
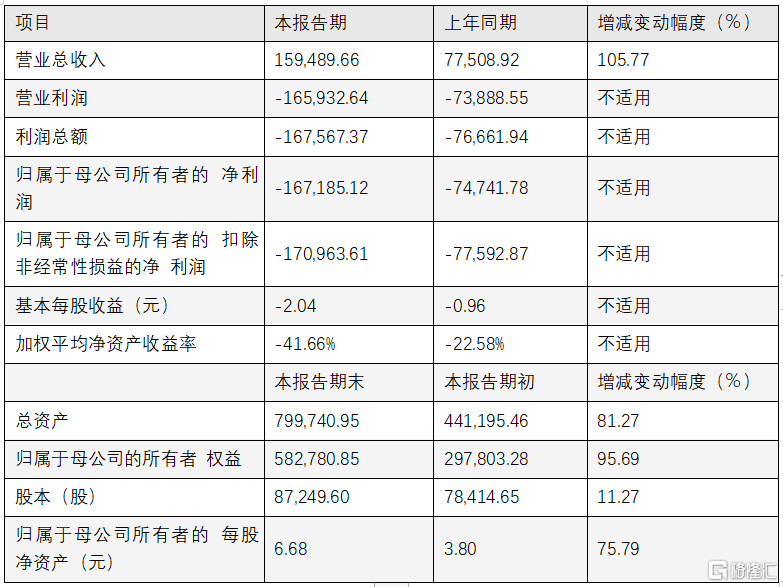
数据来源:君实生物业绩快报,格隆汇整理
小结
此次君实生物发布的业绩快报,可以看得出来公司研发引擎强劲,在PD-1和中和抗体双轮驱动之下为公司带来业绩增长。
一方面,在核心产品特瑞普利单抗销售额增长的背后,正是君实生物在医院覆盖率提升的体现。公司与Coherus、阿斯利康强强联手补齐销售短板后,其出口海外+扩宽适应症的产品策略,更是让特瑞普利单抗商业化进程不断提速。
与此同时,新冠疫情之下动作迅速的君实生物,在研的新冠双抗体疗法已经获美国紧急授权使用,有望为公司在2021带来爆炸性增长。
总体来看,随着公司产品管线的不断丰富和对药物联合治疗的进一步探索,公司的创新研发领域已经从单抗扩展至多个药物类型进行探索,包括小分子药物、抗体药物偶联物(ADC)、双功能融合蛋白、细胞治疗等。随着探索步伐的不断迈进,探索的成果也将转化为复合的营收来源,为投资者创造持续的回报。






